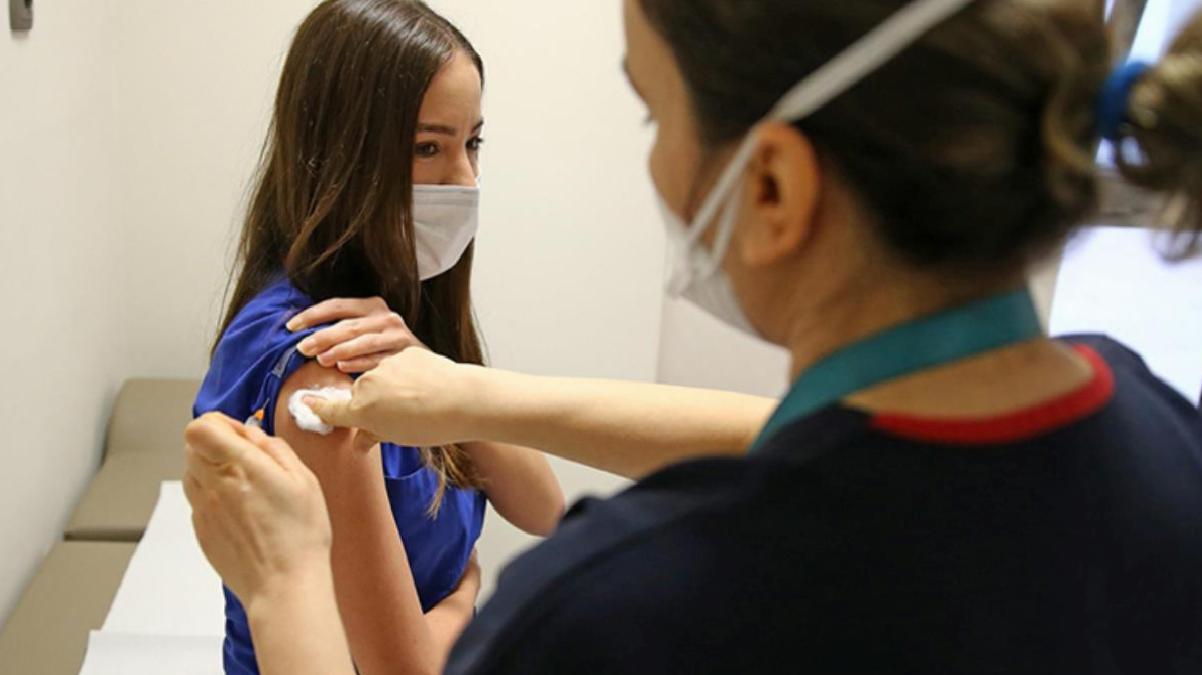
Pfizer ve BioNTech’in mRNA teknolojisiyle geliştirdiği Kovid-19 aşısının birinci dozları Türkiye genelinde dün uygulanmaya başlandı. Sıhhat Bakanlığı, Türkiye’ye getirilen ve özel şartlarda saklanan 2.8 milyon doz BioNTech’in mRNA aşısının (BNT162b2) uygulanmasıyla ilgili kılavuz yayınladı. Aşı randevusu sırasında tercih edenlere BioNTech aşısının birinci dozu yapılıyor. Aşının 2’nci dozu ise 4 hafta sonra uygulanacak.
“6 SAAT İÇİNDE KULLANILMALI”
Kılavuzda, aşının enjektörsüz olarak sunulduğu belirtilerek, şu bilgilere yer verildi:
“Aşı flakonları sert sarsıntılardan ve darbelerden korunmalıdır. Kullanılmadan evvel sulandırılarak seyreltilmelidir. Flakon sulandırılmadan evvel yahut sulandırıldıktan sonra görünümünde beklenmeyen bir durum gözlemlendiğinde, bu durum mümkünse fotoğraf ile belgelenmeli ve tutanak tutularak Halk Sıhhati Genel Müdürlüğü Aşı ile Önlenebilir Hastalıklar Daire Başkanlığı’na iletilmek üzere, aşının tedarik edildiği üniteye en süratli biçimde bilgi verilmelidir. Sulandırılmamış flakonun görünümü beyaz-kirli beyaz ortası renkte donmuş çözelti halindedir. Sıvıda rastgele bir renk değişikliği yahut diğer partiküller görüldüğünde ya da sıvı renksiz hale gelirse flakon kullanılmadan uygun halde imha edilmelidir. Erimiş flakon sulandırılmadan evvel nazikçe ve yavaşça 10 sefer aksi yüz edilmelidir. Katiyetle çalkalanmamalıdır. Oda sıcaklığında iken sulandırılmalıdır. Flakon sulandırıldıktan sonra en geç 6 saat içerisinde kullanılacak biçimde planlanma yapılmalıdır.”
SULANDIRMA SAATİ KAYDEDİLMELİ
Kılavuzda, aşının birinci dozunun sonrasında önemli bir alerjik tepki varlığının görülmesi halinde 2’nci dozunun uygulanmayacağı kaydedildi. Pfizer-BioNTech aşısı dünya uygulamalarında alerjik tepki gelişen hadiseler vardı. Aşının 38 santigrat derece ve üzerinde ateşi olan şahıslarda, şimdi kesin teşhis konulamamış akut hastalıklarda, kronik hastalıkların akut atakları sırasında ertelenmesi gerektiğine işaret edilen kılavuzda, “Sulandırılan flakonun üzerine sulandırılma saati kaydedilerek +2 ile +8 santigrat ortasında koruma edilmelidir” uyarısı da yer aldı.
180 GÜN KURALI GETİRİLDİ
mRNA aşısı için, “Kuduz, tetanos toksoidi içeren aşılarla, kızamık, hepatit-A/B aşıları üzere temas sonrası uygulanması gereken aşılarla vakit aralığı bırakılmaksızın uygulanabilir” sözlerine yer verilen kılavuzda, tüberkülin deri testinin ise ya aşıyla birebir gün yapılması ya da aşı uygulamasından en az 4 hafta sonrasına ertelenmesi gerektiği kaydedildi. Aşının en az 4 hafta orta ile 1’er doz olmak üzere toplam 2 doz olarak uygulanacağı hatırlatılan kılavuzda, özetle şu tabirlere yer verildi:
“İkinci bir talimata kadar faal Kovid-19 hastasına, 180 gün içerisinde Kovid-19’u geçirmiş (PCR testiyle doğrulanmış) ve aşının uygulanmasından evvelki 10 gün içerisinde doğrulanmış bir Kovid-19 hadisesiyle temas etmiş bireylere uygulanmayacaktır. Aşının her iki dozu da tıpkı pandemik aşı ile uygulanmalıdır.
HAMİLELİKLE İLGİLİ BİR BİLGİ YOK
“Gebelikte mRNA aşısının uygulanmasına ait data bulunmamaktadır. Kovid-19’u ağır geçirme riski yüksek olan hamilelere kendi istekleri halinde uygulanabilir” denilerek şu sözlere yer verildi:
“Emzirme periyodunda mRNA aşısının uygulanmasına ait bilgi bulunmamaktadır. Kovid-19’u ağır geçirme riski yüksek olan emziren bayanlara kendi istekleri halinde uygulanabilir. Denetimsiz epilepsi ve Guillain-Barre Sendromu, transvers myelit üzere enfeksiyonla ve aşıyla alevlenebilen nörolojik hastalık tanısı bulunanlara takip eden klinisyen tarafından yapılacak değerlendirmeye bağlı olarak aşılama kararı verilir. Kanama bozukluğu olan hastalarda intramüsküler enjeksiyon kanamaya neden olabilir. Aşının içeriğinde bulunan rastgele bir unsura karşı anafilaksi (alerjik şok) hikayesi varlığında aşı uygulanmaz.”